古典力学による水素分子の電子の軌動計算
梅村研究開発事務所 梅村晃由
(長岡技術科学大学名誉教授)
1)緒論
水素原子の電子軌道はN.Borhの原子モデルに基づいて、古典力学によって解明されている。しかし、水素分子の電子軌道は、Schroedinger方程式を通して得られた、水素原子の波動関数の線形結合によって、近似的に知られているに過ぎない。それは、1つの陽子に対してもう1つの陽子と、2つの電子からなる中心力の場で、3つの粒子の位置と運動量を同時に決定することは出来ない、という数学的命題をはらんでいることと、Schroedinger方程式自体が、粒子の存在確率しか与えないということのためである。
ところで、水素の原子において、1つの陽子の近傍に近づく電子は、さまざまな外力の履歴によって、様様な位置と運動量をとるはずであるが、その発光または吸収する光の波長から見て、主要部分は量子化された軌道を描いて、その軌道は円形とすることが出来た。そこで、水素分子においても、電子の主要部分は円形軌道を描いていると仮定すると、水素分子の2つの陽子と、2つの電子の位置と運動量は、クーロン力の釣り合いを計算する古典力学で知ることができる。これによって、水素分子の形状寸法、量子数とエネルギー準位が、原子と同様に、計算されることになり、これをこの論文で示す。なお、この計算は、Schroedinger方程式が作られる前に行われるべきものと思えるが、今日まで知られていないのは、波動関数の示した効果かあまりにも偉大であったため、気づかれなかったのであろう。
2)水素原子の電子軌道のベクトル解析
解析はある位置に水素原子が存在し、そこに第2の陽子が近づき、次に第2の電子が入るという過程で、各粒子にかかるクーロン力の均衡を調べる。そこで、既によく知られているところであるが、最初に水素原子の解析を復習する。原子核からrの位置にある電子が円軌道を描き接線速度vで運動しているとすれば、r方向には、遠心力、
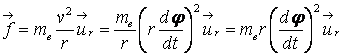 (1)
(1)
が働き、これは核と電子のクーロン引力、
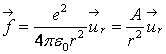 (2)
(2)
に等しい。ここで、meは電子の質量、urはr方向の単位ベクトル、φは軌道の回転角、tは時間、eは電子電荷、ε0は真空中の誘電率である。Aはこれらの定数をまとめた値で、
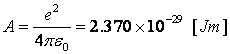 (3)
(3)
である。電子の角運動量と量子数の関係はSommerfeld の定義を用いることとし、接線速度v=r(dφ/dt)およびrが一定の円運動とすれば、
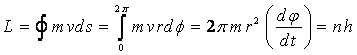 (4)
(4)
と表される。ここで、Lは角運動量、n(=1,2,3,・・・)は量子数、hはPlanck の定数である。(1)式と(2)式が等しい(r方向の力の均衡)とし、(4)式と連立させれば、電子の位置と速度が次のようにも決定される。
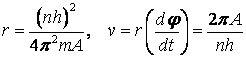 (5)
(5)
特にn=1の基底状態では、
![]() (6)
(6)
となり、r0はボーア半径である。
(5)式を用いると、電子の運動エネルギーは、
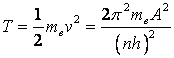 (7)
(7)
となり、ポテンシアルエネルギーは、無限遠をゼロとして、クーロン力を積分し、
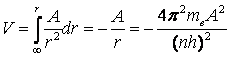 (8)
(8)
となる。したがって、この電子に関する全エネルギーは
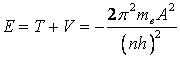 (9)
(9)
となる。(9)式から、水素電子のエネルギー準位表が作られた(Table1)。
3)陽子の接近と水素分子の形成
つぎに、上記の原子に第2の陽子が接近して来たときの電子の挙動を見る。第2の陽子の接近によって電子の軌道面は、第2の陽子の方向に磁場が合うように、その軸を向けると考えられる。そして、第2の陽子の引力が働いて、電子は上方に引かれるが、円運動の接線速度は第2の陽子に対しても遠心力となるため、後に(13)式に示すような合成力の釣り合いが出来て、軌道は第2陽子の方向に浮き上がる。
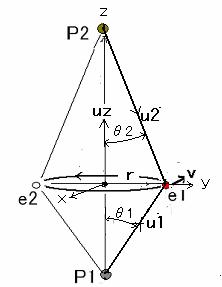 図1水素の電子軌道
図1水素の電子軌道
図1は軌道が少し浮き上がった状態を示す。第1の陽子P1の上方に第2の陽子P2があり、電子e1が円軌道で回転している。方向性を見やすくするためxyz座標を取る。原点を、軌道の中心とし、手前をx、紙面右向きをy、上向きにzをとり、それぞれの方向を示す単位ベクトルをux、uy、uz、とする。ただしx軸とy軸は電子とともにz軸の周りを回転していて、我々はその回転台に立って粒子を見るものとする。P1からe1に向かう方向をu1、P2からe1に向かう方向をu2とする。Z軸とu1のなす角をθ1、u2のなす角をθ2とし、見易さのため角度は何れも正にとる。力の釣り合いは、x方向を無視し、yz平面で見ることができる。単位方向ベクトルはyz平面上で次のように表される。
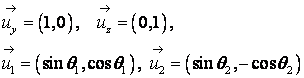 (10)
(10)
そして、図1の位置にある電子に加わる力は
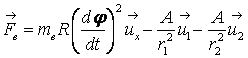 (11)
(11)
と書かれる。右辺第1項は電子の回転による遠心力であり、Rは軌道面の半径である。第2項と3項はそれぞれP1とP2による引力である。Feをz軸に射影すると、
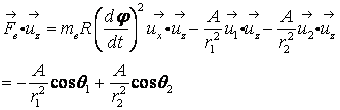 (12)
(12)
となる。ここで、R=r1 sinθ1=r2 sinθ2(図1参照)の関係を入れると、
![]() (13)
(13)
となる。(13)式は、θ1>θ2のとき正、θ1<θ2のとき負となる。このことを図1で見れば、電子は接近して来たP2の方向に力を受けることになる。軌道はこの力で移動して、θ1=θ2=θ0となると力は消え、縦方向に安定することになる。
次に(11)式のFeをy軸に射影すると、
 (14)
(14)
となる。(14)式がゼロになれば、電子は横方向にも安定する。しかし、このままでは、後に示す物理的理由によって、ゼロにすることは出来ない。しかし、もう1つの電子e2が軌道上に置かれれば安定することができる。このとき、e1とe2の二つの電子は、負電苛同士で反発して、軌道面上でπ(180度)だけずれた位置を取るであろう。すなわち、図1で左半分を書き加えた状態となる。このとき、(14)式は、e2による反発力、A/(2R)2が加わるとともに、陽子の引力も半分をe2が負担するので、半減する。したがって、e1にかかる力をF2eとすると、(14)式は次のように変わる。
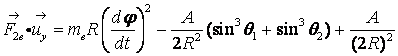 (15)
(15)
(13)式と(15)式がゼロになれば、e1の軌道は上下左右方向に安定する。このときの軌道の半径や電子の速度を決めるのは、量子条件である。量子条件はSommerfeld の定義を用いることとし、分子を表す添え字H2をつけて、書き改めれば次のようになる。
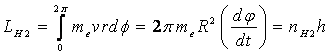 (16)
(16)
ここで、nH2は水素分子に対して、新しく定義される量子数である。
以上電子の力の釣り合い状態が知られたので、つぎに陽子にかかる力FPを見る。P1に
かかる力は、e1とe2の引力とP2の反発力であり、次のように書かれる。
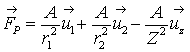 (17)
(17)
これをz軸に射影し、Rを用いて表すと、
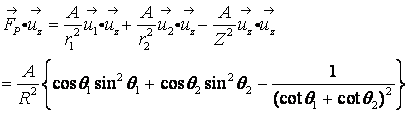 (18)
(18)
となる。y軸に射影すると左右の力が相殺されて、FP・uy=0である。P2については、この式と(18)式の符号を逆にした式が成立する。
結極、上下左右の粒子が安定して定常(平衡)状態となるのは、(13)、(15)、(18)式の値がゼロとなるときである。そして、その状態の電子の位置と速度は、(16)式で決定される。
まず、(15)式がゼロとなるとすると、θ1=θ2=θ0、を得る。これを(18)式に代入して、ゼロとすると、
![]() (19)
(19)
となり、(19)第1式の根として、θ0=π/4の値が決まる。このθ0を(15)式に代入して、ゼロとおき、移項して両辺をA/R2で割ると、
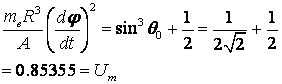 (20)
(20)
を得る。Umはここで定義した無次元数で、分子の大きさや量子数とは独立に、分子の形状のみで決まる定数である。同時に分子の形状の効果を電子の軌道に伝える定数でもある。(20)式と(16)式を連立して解くと、電子の軌道半径Rと速度vが次のように決まる。
 (21)
(21)
これらの半径や速度は原子と較べやすいように、(5)式の原子の値に分子の定数を掛ける形で示した。量子数がnからnH2に代り、大きさは、RがUm分の1、vがUm倍となる。
Rの値を用いると、水素の陽子間距離は、
![]() (22)
(22)
となり、これは一般に報告されている値、0.741×10-10 [m] (化学便覧Ⅱ)の1.67倍である。つぎに、電子1個当たりのエネルギーを求めると、運動エネルギーは次のようになる。
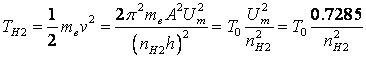 (23)
(23)
そして、ポテンシャルエネルギーは、2つの陽子と1つの電子についての積分、、
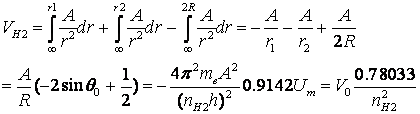 (24)
(24)
となり、やや複雑な係数がつく。そして、全エネルギーは、
 (25)
(25)
となる。ここで、T0、V0とE0は原子の基底状態((7)~(9)式でn=1)の値である。
4)水素分子のエネルギー準位図
電子が軌道遷移するとき発生または吸収する電磁波の波長λは、遷移前後の全エネルギー差から、Planckの式を使って、次のように表される。
![]() (26)
(26)
水素原子については、n1=1,2,3から始まる、n2=n1+1,n1+2,n1+3・・・のエネルギー準位に遷移するエネルギー差の系列に、それぞれ、Lyman、Balmer、Paschenの名前がつけられている。これは(9)式によるもので、λの計算値をつけて、Table 1,に示す。水素分子についても、(25)式により、全く同じ意味の表が作ることが出来る。これをTable 2に示す。また、両者を組み合わせると、原子の軌道、n=1.2.3から、分子の軌道nH2=1,2,3、・・・に遷移するエネルギー準位表が作られ、これをTable 3に示す。これらを、水素分子スペクトルデータと比較すると・・・・・
なお、Table 3で、基底状態の原子から基底状態の分子に移るとき、すなわち、n=1とnH2=1のエネルギー差から計算される、結合エネルギーは440.79[kJ/mol]で、化学便覧 (化学便覧Ⅱ、1993)に登録された結合エネルギー432,07[kJ/mol]に極めて近い。
このあと、測定されたスペクトルデータなどと比較して、妥当性を検討して論文の結論を書く。その場合、共有結合の本質にかかわるので、(14)式がこのままでは成立しない理由を忘れずに。
|
|
Table1 Calculated Energies and Spectra of
an Electron in Hydrogen Atom |
||||||
|
Qt.No |
H [eV] |
H(Lyman) |
|
H(Balmer) |
|
H(Paschen) |
|
|
n |
E(n) |
E(1)-E(n) |
λ |
E(2)-E(n) |
λ |
E(3)-E(n) |
λ |
|
1 |
-13.606 |
[eV] |
[nm] |
[eV] |
[nm] |
[eV] |
[nm] |
|
2 |
-3.401 |
-10.204 |
121.50 |
|
|
|
|
|
3 |
-1.512 |
-12.094 |
102.52 |
-1.890 |
656.11 |
|
|
|
4 |
-0.850 |
-12.755 |
97.20 |
-2.551 |
486.01 |
-0.661 |
1874.61 |
|
5 |
-0.544 |
-13.061 |
94.92 |
-2.857 |
433.94 |
-0.968 |
1281.47 |
|
6 |
-0.378 |
-13.228 |
93.73 |
-3.023 |
410.07 |
-1.134 |
1093.52 |
|
7 |
-0.278 |
-13.328 |
93.03 |
-3.124 |
396.91 |
-1.234 |
1004.67 |
|
8 |
-0.213 |
-13.393 |
92.57 |
-3.189 |
388.81 |
-1.299 |
954.35 |
|
9 |
-0.168 |
-13.438 |
92.27 |
-3.233 |
383.44 |
-1.344 |
922.66 |
|
10 |
-0.136 |
-13.470 |
92.05 |
-3.265 |
379.69 |
-1.376 |
901.25 |
|
|
Table2 Clculated
E. and S. of an Electron in
Hydrogen Molecule |
||||||
|
Qt.No |
H2[eV] |
H2(Lyman) |
H2(Balmer) |
|
H2(Paschen) |
||
|
nH2 |
E(nH2) |
EH2(1)-(n) |
λ |
EH2(2)-(n) |
λ |
EH2(3)-(n) |
λ |
|
1 |
-11.321 |
[eV] |
[nm] |
[eV] |
[nm] |
[eV] |
[nm] |
|
2 |
-2.830 |
-8.491 |
146.02 |
|
|
|
|
|
3 |
-1.258 |
-10.063 |
123.20 |
-1.572 |
788.49 |
|
|
|
4 |
-0.708 |
-10.614 |
116.81 |
-2.123 |
584.07 |
-0.550 |
2252.84 |
|
5 |
-0.453 |
-10.869 |
114.08 |
-2.378 |
521.49 |
-0.805 |
1540.02 |
|
6 |
-0.314 |
-11.007 |
112.64 |
-2.516 |
492.81 |
-0.943 |
1314.15 |
|
7 |
-0.231 |
-11.090 |
111.79 |
-2.599 |
476.99 |
-1.027 |
1207.38 |
|
8 |
-0.177 |
-11.145 |
111.25 |
-2.653 |
467.25 |
-1.081 |
1146.90 |
|
9 |
-0.140 |
-11.182 |
110.88 |
-2.691 |
460.81 |
-1.118 |
1108.82 |
|
10 |
-0.113 |
-11.208 |
110.62 |
-2.717 |
456.30 |
-1.145 |
1083.09 |
|
|
Table3 C, E.and S.
of an Elec. transported from H. Atom to Molecule |
||||||
|
Qt.No |
H2[eV] |
H(n=1)-H2 |
[nm] |
H(n=2)-H2 |
|
H(n=3)-H2 |
|
|
nH2 |
E(nH2) |
E(1)-EH2(n) |
λ |
E(2)-EH2(n) |
λ |
E(3)-EH2(n) |
λ |
|
1 |
-11.321 |
-2.284 |
542.78 |
[eV] |
[nm] |
[eV] |
[nm] |
|
2 |
-2.830 |
-10.775 |
115.06 |
-0.571 |
2171.11 |
|
|
|
3 |
-1.258 |
-12.348 |
100.41 |
-2.143 |
578.42 |
-0.254 |
4884.99 |
|
4 |
-0.708 |
-12.898 |
96.13 |
-2.694 |
460.25 |
-0.804 |
1541.80 |
|
5 |
-0.453 |
-13.153 |
94.26 |
-2.949 |
420.49 |
-1.059 |
1170.89 |
|
6 |
-0.314 |
-13.291 |
93.28 |
-3.087 |
401.64 |
-1.197 |
1035.57 |
|
7 |
-0.231 |
-13.375 |
92.70 |
-3.170 |
391.07 |
-1.281 |
968.10 |
|
8 |
-0.177 |
-13.429 |
92.33 |
-3.225 |
384.50 |
-1.335 |
928.83 |
|
9 |
-0.140 |
-13.466 |
92.07 |
-3.262 |
380.13 |
-1.372 |
903.69 |
|
10 |
-0.113 |
-13.492 |
91.89 |
-3.288 |
377.06 |
-1.399 |
886.53 |
<論文概要>
水素原子の電子軌道は波動方程式を解く方法で確定し、これをもとに元素の軌道が定められている。水素分子については、いまだ波動方程式の完全解が得られていない。ここでは、衛星軌道の類推から、電子が陽子の周りを種々の楕円軌道で運動しているものとみなし、その平均として、同様の角運動量を持つ円軌道を想定した。Sommerfeldが量子条件を水素原子に適用した例を参考とし、水素原子に第2陽子が近づいたとき、電子にかかるクーロン力を古典力学の手法で計算した。その結果、電子の軌道は第2陽子に向かって浮き上がるが、1つの電子では陽子間軸と直角方向の力の釣り合いがとれず、電子は軌道外に飛び去ることが分かった。しかし、第2の電子をおくと、互いの反発力と陽子間反発力が釣り合い、電子の円軌道が維持され、水素分子となることが分かった。このときの軌道半径は相当量子数1として、0.51988×10-10m、陽子間距離は1.2386×10-10mとなった。紫外可視分光測定値から平衡構造として報告されている値(化学便覧Ⅱ、1993)は、0.741×10-10。これに比べ、陽子間距離は1.67倍となっている。また、基底状態で、原子から分子を作る時の結合エネルギーは、440.79[kJ/mol]で、化学便覧 (上記)に登録された結合エネルギー432,07[kJ/mol]に極めて近い。